La FDA comienza a reconocer los daños del método anticonceptivo Essure de Bayer
La agencia estadounidense de medicamentos, la FDA, ha publicado una nueva guía (no vinculante) para la industria y el personal de la institución sobre el método anticonceptivo Essure. En ella también se especifican las directrices del estudio postmarketing que tiene que realizar Bayer, su fabricante, por los muchos daños que está provocando en sus usuarias.
En julio de 2014, comencé a publicar desde España sobre los daños del método anticonceptivo Essure. La principal “ventaja” de dicho método de control de natalidad es que consigue la esterilización de la mujer que lo porta sin que haya que recurrir a la «cirugía invasiva«. Pero en los últimos años sus efectos secundarios se han ido sumando y las víctimas multiplicando.
Por ir a lo importante sobre la nueva guía, la FDA continúa con la idea de no retirar el producto del mercado, ni por el principio de precaución (lo lógico sería apartarlo hasta que se demuestre que es seguro).
Es cierto que la recomendación es de no retirada, pero al menos van a poner dos black box warnings, la indicación de máxima alerta que concede la FDA a los productos sanitarios más peligrosos.
Comento que esta guía no es vinculante, simplemente aconseja a la industria y a los miembros de la FDA. El documento no entra en la valoración de los componentes de Essure, ni de otros métodos de esterilización femenina parecidos o similares.
La guía establece consejos relativos a la información al paciente y establece un modelo de consentimiento informado dirigido a los pacientes y a los profesionales sanitarios. Como os cuento, es importante saber que el texto aconseja la introducción de boxed warning, es decir, requerimientos que hace la FDA al fabricante relativos a la información al paciente.
El primer aviso está relacionado con la información, tanto de los riesgos y efectos adversos del producto, como del procedimiento quirúrgico adecuado para su retirada, todo ello basado en la literatura científica del momento y la experiencia postcomercialización del producto anticonceptivo.
El segundo aviso está relacionado con la inclusión de un modelo de consentimiento informado adecuado para el paciente, que deben firmar el médico y la usuaria, de cara a que la decisión de la paciente esté correctamente informada.
La guía también incorpora un checklist con información sobre el producto. Es decir, para mejorar la información del producto. Como me cuenta mi compañero abogado en el >, Francisco Almodóvar:
La importancia de esta guía es que por primera vez se reconocen efectos adversos inmediatos y a medio largo plazo del producto que habían sido o bien ocultados o bien minimizados u obviados o no se conocían en el momento de comercialización del producto.
La Guía refuerza las garantías de información del producto para que las pacientes estén informadas de manera adecuada y veraz, cosa que, hasta ahora, no lo habían estado, ni en USA, ni en la Unión Europea (UE)».
Es muy destacado el énfasis del documento en los riesgos del producto. También indica que no se conoce ningún test adecuado para predecir si la paciente puede o no tener alergia o intolerancia a los componentes.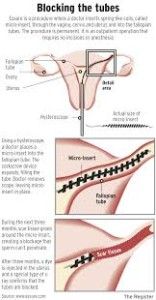
Otro aspecto destacado es que la guía urge a la comunidad médica para que se establezca un protocolo adecuado de retirada, aunque poco dice del protocolo de retirada de fragmentos del producto, que el documento reconoce que también puede ocurrir.
No cita el texto nada sobre los componentes y aleaciones de los componentes del producto, pero sí alerta sobre que las pacientes deben estar informadas sobre el riesgo en caso de resonancias magnéticas y alergias, debido a que el producto incorpora metales pesados.
Aunque, repetimos, no es el propósito de la Guía informar al respecto, simplemente se centra en la información al paciente.
Es interesante reseñar que la FDA indica que otros métodos alternativos deben también explicarse, con sus beneficios y riesgos. Esto tampoco suele hacerse, es novedad.
Por último, la Guía incorpora un modelo de consentimiento informado que es lo mejor que hemos visto hasta ahora, pues está centrado en la paciente. También este modelo hace firmar al médico en cuanto a conocedor del producto y en cuanto a garantizar que la usuaria ha sido realmente informada.
En realidad, el documento de la autoridad sanitaria estadounidense pone un parche a una situación que hasta ahora no se había producido, es decir, hasta ahora no se ha informado a las pacientes de manera responsable, conforme a la ley y a la literatura científica. Ahora sí la FDA, urge a dicha información.
Eso en USA porque en la UE y en España las autoridades continúan con oídos sordos y dando la sensación de que no se enteran de los daños que está provocando Essure. Ya podéis imaginar: todavía siguen defendiendo que el producto no ocasiona efectos adversos o tiene riesgos que ya en USA dan por hecho.
La pregunta por tanto es: ¿Por qué en Europa no existen este tipo de iniciativas cuando sí hay una Agencia Europea de Medicamentos (EMA)? ¿Por qué la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) no ha empezado un estudio o un trabajo parecido?
Desde el bufete seguimos desarrollando acciones legales para defender los derechos de las muchas mujeres afectadas por Essure.
Para contactar con la Asociación de Afectadas por Essure en España: victimasessure (@) gmail.com



Hola mirar yo tengo Essure puesto pero a mi en ningún momento no me dijieron que no se podía quitar pero yo me volví a casar i quería tener un hijo con mi marido pero ahora es imposible mi relación cada día va más fatal k nada k ya veremos si no nos separamos a mi no me hicieron ne la revisión de los tres meses cuando te lo ponen el médico seque a otro hospital a un nose nada de el. Gracias por todo.